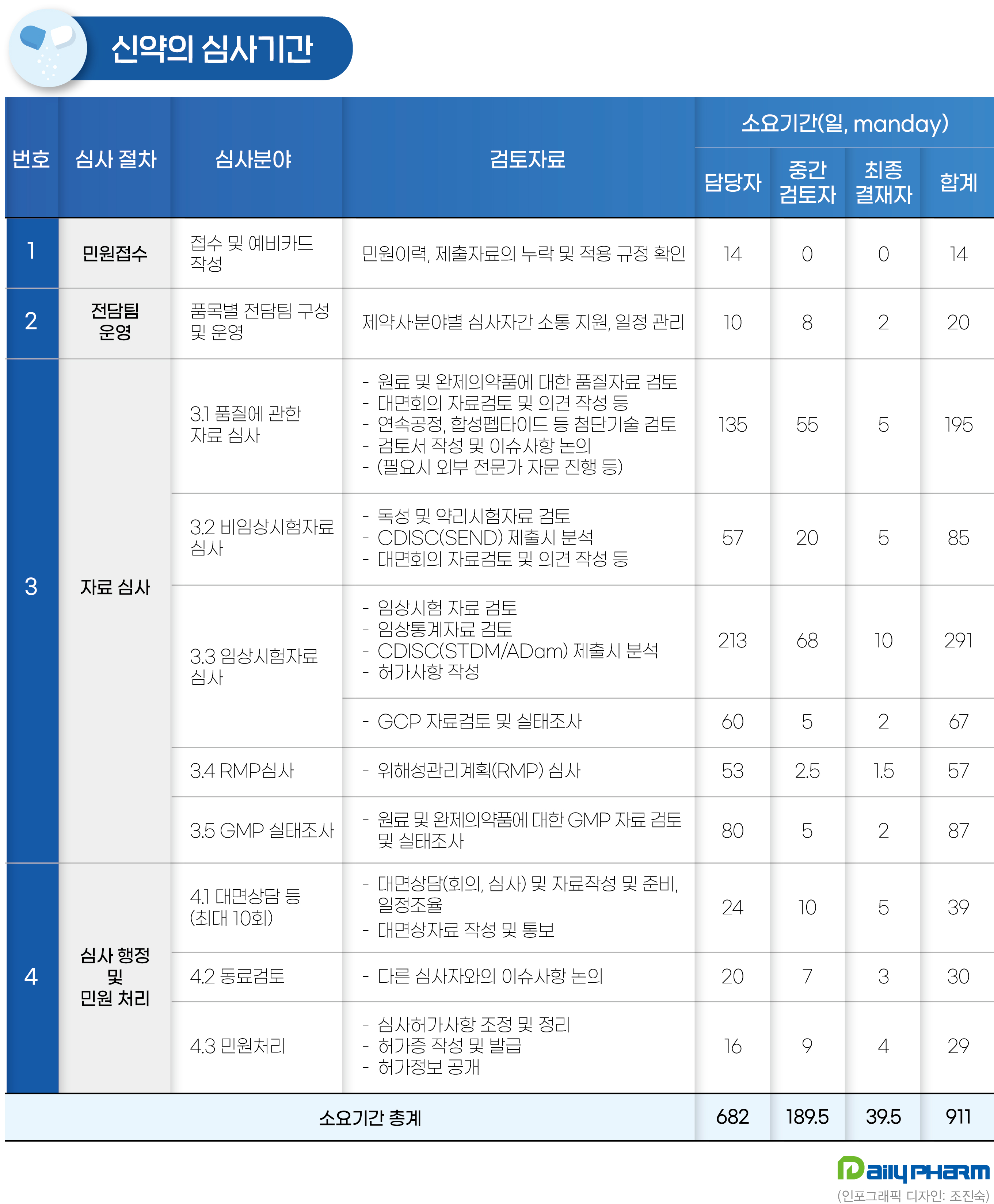
🔹 허가 임상 정책"찔러보기식 신청"...신약 허가수수료 대폭 인상으로, 데일리팜식약처는 지난 9월 9일 신약 허가 수수료를 4억1000만원으로 올리고 전담 심사팀을 신설해 허가 기간을 기존 420일에서 295일로 단축한다는 내용을 담은 '의약품 등의 허가 등에 관한 수수료 규정’ 개정안을 9일 행정예고했다. 그동안 우리나라는 신약 허가 심사비용으로 전자민원 800만원, 방문·우편민원 890만원을 받아왔는데 이를 악용하는 일부 기업으로 인해 불필요한 인력 소요가 발생했다. "의약품 또는 의료기기에 대한 안전성과 유효성이 충분히 입증되지 않았다 하더라도 찔러보기식의 심사신청을 하는 경우가 발생하고 있으며, 이로 인해 오히려 컨설팅 받는 효과가 발생한다."연구 보고서에도 적힌 이 문구는 식약처 심사 관계자들..