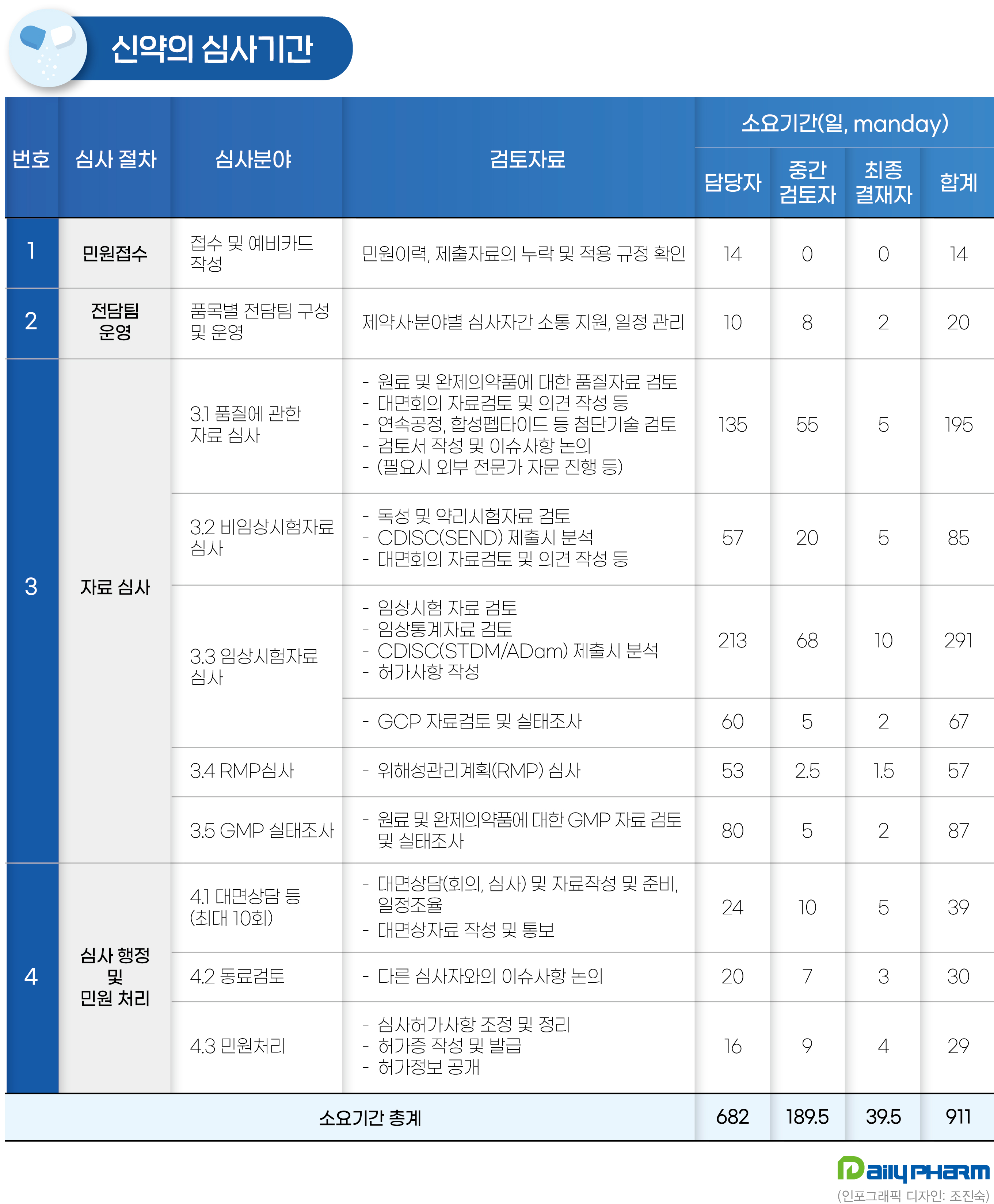
어느 한 분야에라도 벼르고 벼려서 날카로운 부분이 있는 사람은 정말 멋있는 것 같다. 어른스러운 매너와 발화능력, 그런 태도를 갖추고 있다는 가정 하에.. 모든 것을 잘하는 반듯한 정육각형 인간이 되기는 어렵지만 여섯개 꼭짓점이 어디에 있는지 알아두면 일단 육각형은 그릴수 있지 않을까 이번학기의 사이드 프로젝트는 하기 주제에 대해 조사해서 티스토리 블로그에 글을 쓰는 것이다. 1. 바이오 제약시장 전반 탐색- 국내 대표 3사의 사업분석(어떤 사업이 대표적이고 어떤 분야에 투자 중인지. 매출, 기업경영, 가능하다면 경영진 관련 이슈, 관계사에 대해서도, 채용현황 - 어느분야, 어떤 경력 소유자를?, 신입이라면?)- 바이오 시장의 핵심 분야 (마케팅 제외, 연구, 임상, 허가, 약가, 품질관리 중 무엇이 ..